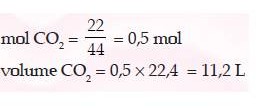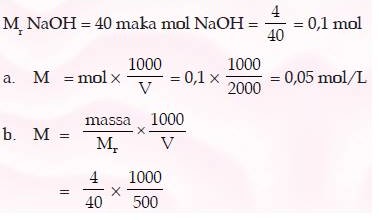Berikut adalah tips bagaimana kita bisa menyelesaikan soal stoikiometri dengan mudah.
mol = gr/Mr
Untuk lebih melengkapi, boleh dibaca materinya sebagai berikut:
Massa Atom Relatif dan Massa Molekul Relatif
Setelah ditemukan peralatan yang sangat peka di awal abad XX, para ahli kimia melakukan percobaan tentang massa satu atom. Sebagai contoh, dilakukan percobaan untuk mengukur.
1. massa satu atom H = 1,66 –> 10–24 g
2. massa satu atom O = 2,70 –> 10–23 g
3. massa satu atom C = 1,99 –> 10–23 g
Dari data di atas dapat dilihat bahwa massa satu atom sangat kecil. Para ahli sepakat menggunakan besaran Satuan Massa Atom (sma) atau Atomic Massa Unit (amu) atau biasa disebut juga satuan Dalton. Pada materi struktur atom,
Anda telah mempelajari juga bahwa atom sangatlah kecil, oleh karena itu tidak mungkin menimbang atom dengan menggunakan neraca.
1. Massa Atom Relatif (Ar)
Para ahli menggunakan isotop karbon C–12 sebagai standar dengan massa atom relatif sebesar 12. Massa atom relatif menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C–12. Atau dapat dituliskan:
1 satuan massa atom (amu) = 1/12 massa 1 atom C–12
Contoh:
Massa atom rata-rata oksigen 1,33 kali lebih besar dari pada massa atom karbon –12.
Maka: Ar O = 1,33 –> Ar C–12
= 1,33 –> 12
= 15,96
Para ahli membandingkan massa atom yang berbeda-beda, menggunakan skala massa atom relatif dengan lambang ”Ar”.
Para ahli memutuskan untuk menggunakan C–12 atau isotop 12C karena mempunyai kestabilan inti yang inert dibanding atom lainnya. Isotop atom C–12 mempunyai massa atom 12 sma. Satu sma sama dengan 1,6605655 x
10–24 g. Dengan digunakannya isotop 12C sebagai standar maka dapat ditentukan massa atom unsur yang lain.
Massa atom relatif suatu unsur (Ar) adalah bilangan yang menyatakan
perbandingan massa satu atom unsur tersebut dengan 1/12 massa satu atom C–12.
ArX = ( massa atom rata – rata X ) / ( 1/2 massa atom karbon – 12 )
Tabel Massa Beberapa Isotop
Jika diketahui massa 1 atom oksigen 2,70 x 10–23 g, berapakah Ar atom O jika
massa atom C 1,99 x 10–23 g?
Jawab:

Besarnya harga Ar juga ditentukan oleh harga rata-rata isotop tersebut. Sebagai contoh, di alam terdapat 35Cl dan 37Cl dengan perbandingan 75% dan 25% maka Ar Cl dapat dihitung dengan cara:
Ar Cl = (75% x 35) + (25% x 37) = 35,5
Ar merupakan angka perbandingan sehingga tidak memiliki satuan. Ar dapat dilihat pada Tabel Periodik Unsur (TPU) dan selalu dicantumkan dalam satuan soal apabila diperlukan
2. Massa Molekul Relatif (Mr)
Molekul merupakan gabungan dari beberapa unsur dengan perbandingan tertentu. Unsur-unsur yang sama bergabung membentuk molekul unsur, sedangkan unsur-unsur yang berbeda membentuk molekul senyawa. Massa molekul unsur atau senyawa dinyatakan oleh massa molekul (Mr). Massa molekul relatif adalah perbandingan massa molekul unsur atau
senyawa terhadap 1/12 x massa atom C–12. Secara matematis dapat dinyatakan:
 C. Konsep Mol dan Tetapan Avogadro
C. Konsep Mol dan Tetapan Avogadro
Apabila Anda mereaksikan satu atom karbon (C) dengan satu molekul oksigen (O2) maka akan terbentuk satu molekul CO2. Tetapi sebenarnya yang Anda reaksikan bukan satu atom karbon dengan satu molekul oksigen, melainkan sejumlah besar atom karbon dan sejumlah besar molekul oksigen. Oleh karena jumlah atom atau jumlah molekul yang bereaksi begitu besarnya maka untuk menyatakannya, para ahli kimia menggunakan ”mol” sebagai satuan jumlah partikel (molekul, atom, atau ion).
Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat itu sebanyak atom yang terdapat dalam 12,000 g atom karbon –12.
Jadi, dalam satu mol suatu zat terdapat 6,022 x 1023 partikel. Nilai 6,022 x 1023 partikel per mol disebut sebagai tetapan Avogadro, dengan lambang L atau N. Dalam kehidupan sehari-hari, mol dapat dianalogikan sebagai ”lusin”. Jika lusin
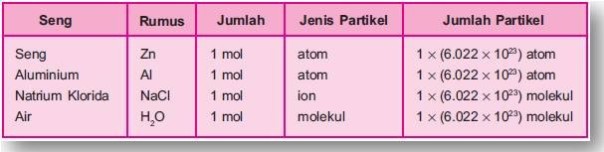
menyatakan jumlah 12 buah, mol menyatakan jumlah 6,022 x 10 23 partikel zat. Kata partikel pada NaCl, H2O, dan N2 dapat dinyatakan dengan ion dan molekul, sedangkan pada unsur seperti Zn, C, dan Al dapat dinyatakan dengan atom.
Perhatikan tabel berikut!
Tabel Jumlah Partikel dalam Beberapa Zat
Rumus kimia suatu senyawa menunjukkan perbandingan jumlah atom yang ada dalam senyawa tersebut.
Tabel Perbandingan Atom-Atom dalam H2SO4
Contoh Soal
Massa satu mol zat dinamakan massa molar (lambang Mr). Besarnya massa molar zat adalah massa atom relatif atau massa molekul relatif zat yang dinyatakan dalam satuan gram per mol.
Massa molar = Mr atau Ar zat (g/mol)
Perhatikan contoh pada tabel berikut!
Tabel Massa Molar Beberapa Zat
Massa suatu zat merupakan perkalian massa molarnya (g/mol) dengan mol zat tersebut (n). Jadi hubungan mol suatu zat dengan massanya dapat dinyatakan sebagai berikut.
massa molarnya (g/mol) dengan mol zat tersebut (n). Jadi hubungan mol suatu zat dengan massanya dapat dinyatakan sebagai berikut.
Secara matematis, dapat dinyatakan sebagai berikut.
Massa molar = massa : mol
Massa = mol x Mr/Ar (massa molar)
Contoh Soal
2. Volume Molar (Vm)
Volume satu mol zat dalam wujud gas dinamakan volume molar, yang dilambangkan dengan Vm.
Berapakah volume molar gas? Bagaimana menghitung volume sejumlah tertentu gas pada suhu dan tekanan tertentu?
Avogadro dalam percobaannya mendapat kesimpulan bahwa 1 L gas oksigen pada suhu 0° C dan tekanan 1 atm mempunyai massa 1,4286 g, atau dapat dinyatakan bahwa pada tekanan 1 atm:
Maka, berdasarkan hukum Avogadro dapat disimpulkan:
1 mol gas O2 = 22,4 L
Sesuai dengan hukum Avogadro yang menyatakan bahwa pada suhu dan tekanan yang sama, volume gas yang sama mengandung jumlah molekul yang sama atau banyaknya mol dari tiap-tiap gas volumenya sama. Berdasarkan hukum tersebut berlaku volume 1 mol setiap gas dalam keadaan standar (suhu 0° C dan tekanan 1 atm) sebagai berikut.
Volome gas dalam keadaan standar = 22,4 L
Contoh soal
Berapa volume gas CO2 yang massanya 22 g (Ar : C = 12, O = 16) jika diukur pada
tekanan 1 atm?
Jawab:
Mr CO2 = 44Berapa volume gas CO2 yang massanya 22 g (Ar : C = 12, O = 16) jika diukur pada
tekanan 1 atm?
Jawab:
Mr CO2 = 44
3. Volume Gas pada Keadaan Tidak Standar
Perhitungan volume gas tidak dalam keadaan standar (non-STP) digunakan dua pendekatan sebagai berikut.
a. Persamaan gas ideal
Dengan mengandaikan gas yang akan diukur bersifat ideal, persamaan yang menghubungkan jumlah mol (n) gas, tekanan, suhu, dan volume
yaitu:
Hukum gas ideal : P . V = n . R . T
Di mana:
P = tekanan (satuan atmosfir, atm)
V = volume (satuan liter, L)
n = jumlah mol gas (satuan mol)
R = tetapan gas (0,08205 L atm/mol K)
T = suhu mutlak (°C + 273,15 K)
Contoh Soal
Tentukan volume dari 4,4 g gas CO2 yang diukur pada tekanan 2 atm dan suhu
27° C! (Ar : C = 12, O = 16)
b. Dengan konversi gas pada suhu dan tekanan yang sama
Menurut hukum Avogadro, perbandingan gas-gas yang jumlah molnya sama memiliki volume sama. Secara matematis dapat dinyatakan sebagai berikut.
V1/V2 =n1/n2
Di mana:
n1 = mol gas 1 V1 = volume gas 1
n2 = mol gas 2 V2 = volume gas 2
Contoh Soal
Berapa volume 4 g gas metana (CH4) yang diukur pada keadaan sama dengan
3 g NO volumenya 5 L (Ar : H = 1, C = 12, N = 14, O = 16)?
Jawab:
Mr CH4 = 16
4. Molaritas (M)
Banyaknya zat yang terdapat dalam suatu larutan dapat diketahui dengan menggunakan konsentrasi larutan yang dinyatakan dalam molaritas (M). Molaritas menyatakan banyaknya mol zat dalam 1 L larutan. Secara matematis dinyatakan sebagai berikut.
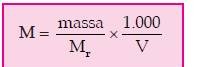 Di mana:
Di mana:
M = molaritas (satuan M)
massa = dalam satuan g
Mr = massa molar (satuan g/mol)
V = volume (satuan mL)
Contoh Soal
Tentukan molaritas jika 4 g NaOH dilarutkan dalam:
a. 2 L air
b. 500 mL air
Jawab:
Hubungan mol dengan massa, jumlah partikel dan volume pada STP, dapat digambarkan sebagai berikut.